ساختار جدول تناوبی (مندلیف)
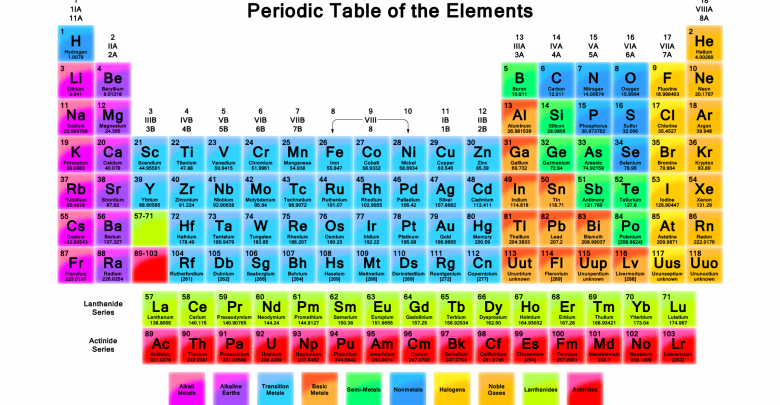
امروزه جدول تناوبی عناصر، تصویر آشنایی در کلاس های درس سراسر دنیا است؛ اما دو قرن پیش، چنین تصویری حتی برای دانشمندان پیشرو علم شیمی آرزویی دست نیافتنی بود. حدود یک قرن طول کشید تا ساختار این جدول بطور کامل درک و تکمیل شود.
در این مقاله شما می توانید با دانشمندان پیشرو و یافته هایی که ما را به این درک رسانده اند، آشنا شوید.
نقل مشهوری منسوب به فیزیکدان شهیر، ارنست رادرفورد وجود دارد که روزی برای عصبانی کردن دانشمندان حوزه های دیگر گفته بود: «همه دانش یا فیزیک است یا کلکسیون تمبر.» بنابراین کنایه آمیز به نظر می رسد وقتی رادرفورد در سال 1908، جایزه نوبل را برای انجام یک آزمایش فیزیک دریافت کرد، این جایزه در حوزه شیمی به او اعطا شد. البته رادرفورد هم این جایزه را با خوش خلقی دریافت کرد و شوخی بامزه ای درباره دگردیسی ناگهانی اش از یک فیزیکدان به شیمیدان با حضار کرد.
درک امروزی ما از عناصر مدیون هر دو دانش فیزیک و شیمی است و رادرفورد هم نقشی کلیدی در ارائه و شکل گیری قانون تناوبی حاکم بر عناصر شیمیایی داشت که در قرن بیستم تکمیل شد؛ قانونی که حدود 150 سال پیش و در سال 1869 بوسیله دمیتری مندلیف (Dmitri Mendeleev) و شیمیدان های دیگر کشف شد. جالب اینجا است که مندلیف هم اگرچه به عنوان یک شیمیدان شناخته می شد، اما تقریباً هیچ وقتی را در آزمایشگاهش به جستجوی عناصر شیمیایی اختصاص نداد.
سنگ بنای اول
این موضوع که چه چیزی را باید به عنوان یک عنصر شیمیایی در نظر گرفت، مسئله ای بود که قرن ها مورد بحث و منازعه دانشمندان بود؛ مشکلی که امروزه هم حتی تا حدودی حل نشده باقی مانده است. مفهوم عنصر به دوران فلاسفه یونان باستان باز می گردد. آنها تنها چهار عنصر زمینی را به رسمیت می شناختند؛ آب، خاک، هوا و آتش.
این عناصر اربعه در تناظر با چهار جسم افلاطونی شناخته شده بودند: چهار وجهی، مکعب، هشت وجهی و بیست وجهی. بر همین اساس، سیال بودن آب با شکل نسبتاً هموار بیست وجهی متناظر دانسته می شد، حال آنکه درد ناشی از لمس آتش با گوشه های تیز چهار وجهی توضیح داده می شد. وقتی بعدها پنجمین جسم افلاطونی (دوازده وجهی) کشف شد، ارسطو پیشنهاد وجود عنصر پنجمی را مطرح کرد، عنصر کیهانی اتر.
بعضی از 92 عنصر طبیعی که امروزه ما به عنوان عناصر طبیعی می شناسیم، از دوران باستان و حتی پیشتر برای بشر شناخته شده بودند؛ عناصری مانند کربن، مس، طلا، آهن، سرب، جیوه، نقره، قلع و گوگرد. این مواد یا به شکل غیر ترکیب در طبیعت یافت می شدند یا به سهولت از سنگ معدن شان قابل جداسازی بودند. برای قرن ها، کیمیاگران خودشان را در تلاشی نافرجام برای تبدیل فلزات پایه مانند آهن و سرب، به فلزات نجیب طلا و نقره مشغول کرده بودند. شدت این تلاش ها به حدی بالا گرفته بود که فیلسوف مشهور فرانسیس بیکن در دهه 1620 در مذمت آن این چنین نوشت: «همه فلسفه طبیعت که امروزه در اختیار بشر است، یا فلسفه یونانیان است یا فلسفه کیمیاگران. یکی هرگز در تکثیر کلام شکست نخورد و دیگری همواره در تکثیر طلا شکست خورد.»
ماده مدرن
مفهوم امروزی عنصر شیمیایی تنها در اواخر قرن هیجدهم میلادی و بوسیله شیمیدان فرانسوی، آنتوان لاوازیه مطرح شد. لاوازیه را عموماً به عنوان پدر شیمی مدرن می شناسند که آن را از دهه 1770 تا پایان عمرش در سال 1794 بنیانگذاری کرد. با انجام آزمایش های کمی (که مقدار نسبی یک یا چند ماده را به صورت عددی مشخص می کند)، لاوازیه عنصر را جسمی مادی تعریف کرد که قابل تجزیه به مواد ساده تر نیست. در سال 1789، لاوازیه کتاب رساله ای مقدماتی در باب شیمی را منتشر کرد که در آن 33 ماده ساده یا عنصر را فهرست کرده بود. بسیاری از این مواد امروزه هم به عنوان عنصر، مورد پذیرش هستند که شامل گازهای هیدروژن و اکسیژن، فلزات شناخته شده از دوران باستان به همراه منگنز، مولیبدن و تنگستن و غیر فلزات شامل کربن، گوگرد و فسفر می شد. اما دیگر عنصرهای شیمیایی پیشنهادی در فهرست لاوازیه شامل آهک و باریتا (باریم هیدروکسید) بود که امروزه جزء مواد مرکب طبقه بندی می شوند و همچنین شامل نور و حرارت (کالری) بود که به حوزه فیزیک متعلق هستند. با وجود این، لاوازیه بدرستی مفهوم عناصر اربعه پیشنهادی یونانیان باستان را رد کرد و نشان داد که آنها در اصل از مواد بنیادی تری ساخته شده اند.
گام بعدی در طبقه بندی عناصر بوسیله شیمیدان انگلیسی جان دالتون و در سال 1803 برداشته شد. دالتون فرض کرد هر عنصر از نوع خاصی از اتم ساخته شده است؛ ماهیتی نادیدنی که بنیان همه مواد را شکل می داد. بر اساس داده های لاوازیه، دالتون وزن نسبی چند عنصر مهم را با تحلیل ترکیبات شیمیایی ساده تخمین زد. بر همین اساس، به نظر می رسید وزن آب از یک هشتم قسمت هیدروژن و هفت هشتم قسمت اکسیژن تشکیل شده است. در نتیجه و با فرض فرمول HO برای آب، دالتون عدد اتمی 1 را به هیدروژن و عدد اتمی 7 را به اکسیژن نسبت داد. اگرچه مشخصات اندازه گیری شده بوسیله لاوازیه تا حدودی نادقیق بود و فرمول مولکولی دالتون در این مورد خاص دچار اشتباه بود، ولی این رویکرد موفقیت آمیز بود. بعدها در دهه 1860، با اصلاحات انجام شده، ثابت شد وزن نسبی عناصر اهمیتی حیاتی برای شکل دادن یک جدول تناوبی دارد.
شیمیدان آلمانی یوهان ولفگانگ دوبراینر (Johann Wolfgang Döbereiner) آغازگر شکل دهی جدول تناوبی عناصر بود. از سال 1817، او تلاش برای دسته بندی عناصر را آغاز کرد. حدود 10 سال بعد، دوبراینر متوجه شد بعضی گروه های سه تایی عناصر که خواص شیمیایی مشابهی دارند هم، الگویی را از نظر جرم اتمی از خود نشان می دهند. برای مثال، فلزات قلیایی لیتیم، سدیم و پتاسیم به ترتیب دارای جرم اتمی 7، 23 و 39 بودند؛ که نشان می داد جرم اتمی سدیم در میانه جرم اتمی دو عنصر دیگر قرار دارد. این رابطه در همه سه تایی ها برقرار بود. یعنی جرم اتمی عنصر دوم همواره دقیقاً میانگین جرم اتمی عنصر اول و سوم بود. فلزات قلیایی خاکی کلسیم، استرانسیم و باریم و گازهای هالوژن، کلر، برم و ید هم از این قانون پیروی می کردند.
بین سال های 1827 تا 1858، شیمیدان های دیگری مشاهدات دوبراینر را توسعه دادند و منیزیم را به گروه فلزات قلیایی خاکی و فلوئور را هم به هالوژن ها اضافه کردند. همچنین اکسیژن، گوگرد، سلنیم و تلوریم به عنوان یک خانواده و نیتروژن، فسفر، آرسنیک، آنتیموان و بیسموت هم به عنوان خانواده ای دیگر بسته بندی شدند.
رویکردهای چندگانه
سال 1858، شیمیدان ایتالیایی استایزلاو کانیتزارو فهرستی استاندارد از جرم های اتمی و مولکولی منتشر کرد. برای اینکار، او فرضیه سال 1811 شیمیدان و فیزیکدان معاصر خود، آمدئو آووگادرو (Amedeo Avogadro) مشهور را در خصوص گازها احیا کرد. برخلاف دالتون، آووگادرو عقیده داشت گازهایی مانند هیدروژن و اکسیژن از مولکول ها ساخته شده اند که خود آنها از به هم پیوستن اتم ها شکل گرفته اند. در نتیجه، جرم مولکولی گازها باید متفاوت از جرم اتمی عناصر سازنده آنها باشد. جرم مولکولی به این وابسته بود که چند اتم یک عنصر در شکل دادن مولکول گاز مشارکت می کنند. تحلیل کانیتزارو مبنایی برای بحث در نخستین کنگره بین المللی شیمیدان ها شد که در سال 1860 در کارلسروهه آلمان برگزار شد.
دمیتری مندلیف روس، ژولیوس لوتار مایر آلمانی و ویلیام اودلینگ انگلیسی جزء شیمیدان هایی بودند که در این کنگره شرکت کرده بودند. این سه شیمیدان، همراه با دو شیمیدان دیگر به نام های جان نیولندز و گوستاوو هاینریش و زمین شناسی فرانسوی به نام الکساندر بگویه دوشانکورتوآ نسخه های مختلفی از جدول تناوبی را طی دهه 1860 منتشر کردند. آنها تلاش کرده بودند الگوهایی را در جرم اتمی، خواص شیمیایی یا طیف اتمی (کاری که هاینریش انجام داد) 63 عنصری پیدا کنند که تا آن زمان شناخته شده بودند.
جدول پیشنهادی مندلیف که هنگام نوشتن کتابی درسی در زمینه شیمی به آن رسیده بود، آخرین مورد از این شش جدول بود. نسخه اولیه جدول در سال 1869 و نسخه کامل آن دو سال بعد منتشر شد؛ هر چند به نظر نمی رسید تحت تاثیر پنج جدول قبلی قرار داشته باشد. هر کدام از این جدول ها شایستگی قابل توجهی داشتند، اما تنها جدول مندلیف باقی ماند. دلیل اصلی موفقیت جدول مندلیف این بود که طی سال های 1869 تا 1871، او چندین پیش بینی درباره وجود عناصری ناشناخته را بر اساس این جدول انجام داد. او این عناصر را با پیشوند اکا که در زبان سانسکریت به معنی یک است نامگذاری کرد. عناصر پیش بینی شده مندلیف شامل اکا-آلومینیوم، اکا-بور و اکا-سیلیس بودند که به ترتیب باید جرم اتمی 68، 44 و 72 می داشتند. نخستین عنصر در سال 1875 کشف شد و گالیم نام گرفت (با جرم اتمی 69.7)؛ عنصر دوم در سال 1879 کشف شد و اسکاندیم نام گرفت (با جرم اتمی 45.0)؛ و عنصر آخر هم در سال 1886 شناسایی شد که ژرمانیم نامگذاری شد (با جرم اتمی 72.6). علاوه بر این، مندلیف تقریباً همه خواص شیمیایی این عناصر جدید را به درستی پیش بینی کرده بود.
اصل های مشکل دار
البته همه پیش بینی های مندلیف موفقیت آمیز نبود. پیش از مرگ مندلیف در سال 1907، کشف های جدید نظریه او را به چالش کشیدند. در حقیقت، نسخه های فعلی جدول تناوبی سه اصل مورد علاقه مندلیف را نادیده می گیرد: ظرفیت شیمیایی، تقسیم ناپذیری و تغییرناپذیری اتم.
ظرفیت شیمیایی بیانگر تعداد پیوندهایی است که یک اتم می تواند با اتم های دیگر تشکیل دهد. گازهای نجیب (بی اثر) هلیم، نئون، آرگون، کریپتون، رادون و زنون که در دهه 1890 کشف شدند، کاملاً واکنش ناپذیر به نظر می رسیدند و ظرفیت شیمیایی صفر داشتند؛ اما امروزه می دانیم بعضی از آنها ترکیبات اندکی را شکل می دهند. کشف الکترون در سال 1897 بوسیله جی. جی. تامسون فیزیکدان هم بطلانی بر اصل تقسیم ناپذیری اتم کشید و نشان داد اتم ها ساختار داخلی دارند. همچنین پرتوزایی که در سال 1896 بوسیله هانری بکرل کشف و دو سال بعد بوسیله پیر و ماری کوری نامگذاری شد، نشان داد تغییر شکل و دگردیسی عناصر رخ می دهد. عنصرهایی مانند اورانیوم، پولونیم و رادیم همگی دچار واپاشی پرتوزا و به عناصر دیگر تبدیل می شوند.
اما مهم ترین ایراد جدول مندلیف، استناد سفت و سخت آن به روند افزایشی جرم اتمی به عنوان اصل اساسی نظم دهی این جدول بود: هر چقدر جرم اتمی یک عنصر بیشتر باشد، موقعیت آن در جدول تناوبی عقب تر است؛ اصلی که مندلیف بر حفظ آن اصرار شَدیدی داشت. مندلیف، خود نیز به دشواری رعایت این اصل آگاه بود و حتی خودش یکی دو استثناء در این قانون اعمال کرده بود که معروف ترین آن مربوط به تلوریم بود که با وجود وزن اتمی 127.6 که بیشتر از جرم اتمی 126.9 عنصر ید بود، این عنصر پیش از ید در جدول تناوبی قرار گرفته بود. توجیه مندلیف برای این جابجایی، آن بود که جرم اتمی یک یا هر دوی این عنصرها اشتباه تعیین شده اند؛ اما مشخص شد استدلال مندلیف صحیح نیست.
بر اساس اعداد
هر چند تلوریم بی شک جرم اتمی بالاتری از ید دارد، اما امروزه می دانیم عدد اتمی آن که 52 است، کمتر از ید با عدد اتمی 53 است و در نتیجه جایگاهش در جدول مطابق نظر مندلیف صحیح است. عدد اتمی مفهومی ناشناخته برای مندلیف بود. هر چند در بعضی از نسخه های جدول تناوبی قرن نوزدهم، عنصرها صرفاً بر اساس افزایش جرم اتمی شماره گذاری شده بودند؛ اما مفهوم عدد اتمی مدیون کارهای فیزیکدانان است که نقطه اوج آن هم به سال های 1911 تا 1914 و پژوهش های ارنست رادرفورد و هنری موزلی باز می گردد. رادرفورد هسته اتم را کشف کرد؛ پروتون هایی با بار مثبت در آنجا قرار داشتند و الکترون های با بار منفی به دور آن در گردش بودند. موزلی هم پیشنهاد ارائه شده بوسیله اقتصاددان و فیزیکدان آماتور هلندی به نام آنتونیوس فن دان بروویک را پیگیری کرد که عقیده داشت عدد یک عنصر باید متناظر با بار هسته آن، یا همان تعداد پروتون ها باشد. با اندازه گیری طول موج های خطوط طیفی پرتوی ایکس عنصرهای مختلف، موزلی نشان داد این طول موج ها مشخصه ارتباطی تنگاتنگ و نظام مندی با عدد اتمی عناصر دارد.
این عدد اتمی و نه جرم اتمی بود که شاخصه اصلی نظم دهی نسخه های مختلف جداول تناوبی امروزی است. دلیل اینکه جرم اتمی راهنمای موثری برای تعیین مشخصات یک عنصر است، آن است که افزایش جرم اتمی عموماً به موازات افزایش عدد اتمی است؛ زیرا جرم اتمی بر اساس تعداد پروتون ها و نوترون های هسته تعیین می شود. همزمان که تعداد پروتون ها در راستای جدول تناوبی افزایش پیدا می کند، به عنوان قانونی کلی تعداد نوترون ها هم رو به افزایش می گذارد. بنابراین افزایش عدد اتمی و افزایش جرم اتمی عموماً متناظر با هم هستند.
در نهایت، باید به این نکته اشاره کرد که فیزیک اتم ها هرگز بطور کامل نمی تواند رفتار شیمیایی آن را به عنوان یک عنصر پیشگویی کند. برای مثال، سدیم و پتاسیم که دو عضو گروه فلزات قلیایی و نزدیکترین همسایه هم در جدول هستند، می توانند در شرایط مشابه رفتار بسیار متفاوتی داشته باشند: برای نمونه یکی باعث انفجار می شود و دیگری هیچ اتفاقی به وجود نمی آورد. شاید تفاوت ها اندک باشد، اما همین تفاوت های فیزیکی اندک می توانند به نتایج به شدت متفاوتی منجر شوند؛ مانند سوزن خط آهن که یک جابجایی کوچک آن مقصد قطار را کیلومترها تغییر می دهد.
منابع
مقاله علمی و آموزشی «ساختار جدول تناوبی (مندلیف)»، نتیجه ی تحقیق و پژوهش، گردآوری، ترجمه و نگارش هیئت تحریریه علمی پورتال یو سی (شما می توانید) می باشد. در این راستا مقاله محمود حاج زمان در مجله دانستنیها، به عنوان منبع اصلی مورد استفاده قرار گرفته است.