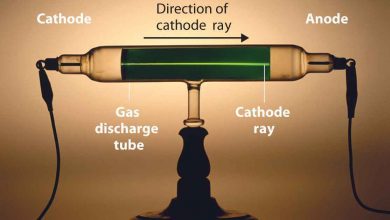
منظور از الکترولیز چیست؟
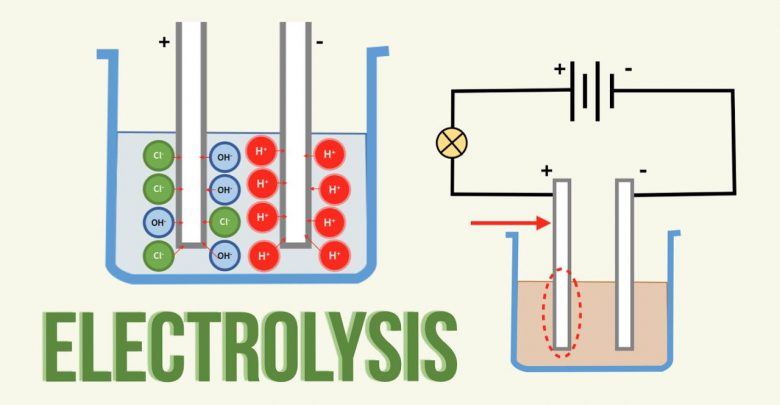
الکترولیز یا برقکافت، فرآیند یا روش جداسازی عناصر یک ترکیب بوسیله عبور دادن جریان الکتریکی از درون محلول یا مایع آن ترکیب است. از الکترولیز برای تجزیه آب به دو گاز تشکیل دهنده آن، یعنی اکسیژن و هیدروژن استفاده میشود. این روش را برای جدا کردن فلزات از محلولها یا شکلهای مذاب ترکیبات فلزی بکار میگیرند. برای مثال سدیم را به روش الکترولیز از کلرید سدیم مذاب جدا میکنند.
اصلیترین موارد استفاده صنعتی آن عبارتند از تصفیه یا خالصسازی فلزات و آبکاری برقی اشیاء.
در الکترولیز، جریان مستقیم یک باتری، بین دو رسانای الکتریکی جامد (به نام الکترود)، رد و بدل میشود. این الکترودها درون محلولی که باید تجزیه یا الکترولیز شود، قرار گرفتهاند.
محلولی که جریان الکتریکی را بین الکترودها هدایت میکند، الکترولیت نام دارد. الکترود منفی را کاتد و الکترود مثبت را آند مینامند. چون جریان الکتریکی در واقع جریان الکترونها است، سطح کاتد الکترونهای اضافی بدست میآورد و یونهای دارای بار مثبت (موجود در محلول) را به سمت خود جذب میکند. یونهای دارای بار منفی، در آند که الکترونها از آن بیرون کشیده میشوند، تجمع میکنند.
وقتی محلول یک ترکیب فلزی الکترولیز میشود، یونهای فلزی مثبت، به سمت کاتد جذب میشوند و بر سطح آن مینشینند. به همین طریق است که اشیاء را با طلا یا نقره آبکاری میکنند.
منابع
- کتاب Kingfisher Science Encyclopedia. تالیف Catherine Headlam. ترجمه محمود سالک. نشر Kingfisher Books. 1991.