برندگان نوبل شیمی 2018 چه دستاوردهایی داشتند؟
سه دانشمند برای استفاده از قدرت زیست شناسی تکاملی در طراحی مولکول هایی که دارای طیفی از کاربردهای علمی هستند، جایزه نوبل شیمی 2018 را میان خود تقسیم کردند. این کاربردها عبارتند از: داروهای جدید، واکنش های موثرتر و با سمیت کمتر در ساخت مواد شیمیایی و سوخت های گیاهی برای جانشینی نفت، گاز و زغال سنگی که از زمین استخراج می شوند.
نیمی از جایزه و مبلغ نقدی یک میلیون دلاری همراه آن به فرانسیس آرنولد (Frances Arnold)، استاد مهندسی شیمی دانشگاه صنعتی کالیفرنیا (کلتک) تعلق گرفت. او پنجمین خانمی است که برنده جایزه نوبل شیمی شده است. نیم دیگر جایزه به تساوی میان جورج اسمیت (George Smith)، استاد بازنشسته علوم زیستی دانشگاه میسوری و گرگوری وینتر (Greg Winter)، زیست شیمیدان آزمایشگاه زیست شناسی مولکولی وابسته به شورای تحقیقات پزشکی در انگلستان تقسیم شد.
در این مقاله شما می توانید با این دستاورد بیشتر آشنا شوید.
این جایزه باریکتر شدن شکاف میان زیست شناسی و بعضی زیرشاخه های شیمی را به تصویر می کشد. با رو آوردن شیمیدانان به طبیعت برای الهام گرفتن از آن، فاصله میان این رشته ها نیز کمتر می شود. دکتر آرنولد در گفتگویی اعلام کرد: «همیشه می خواستم مهندس پروتئین باشم. پروتئین ها ماشین های مولکولی حیرت انگیزی هستند و با آنکه به طرز هولناکی پیچیده اند، اما تمام کارکردهای حیات را به عهده دارند. دلم می خواست مهندس دنیای زیستی باشم.»
منطق تکامل
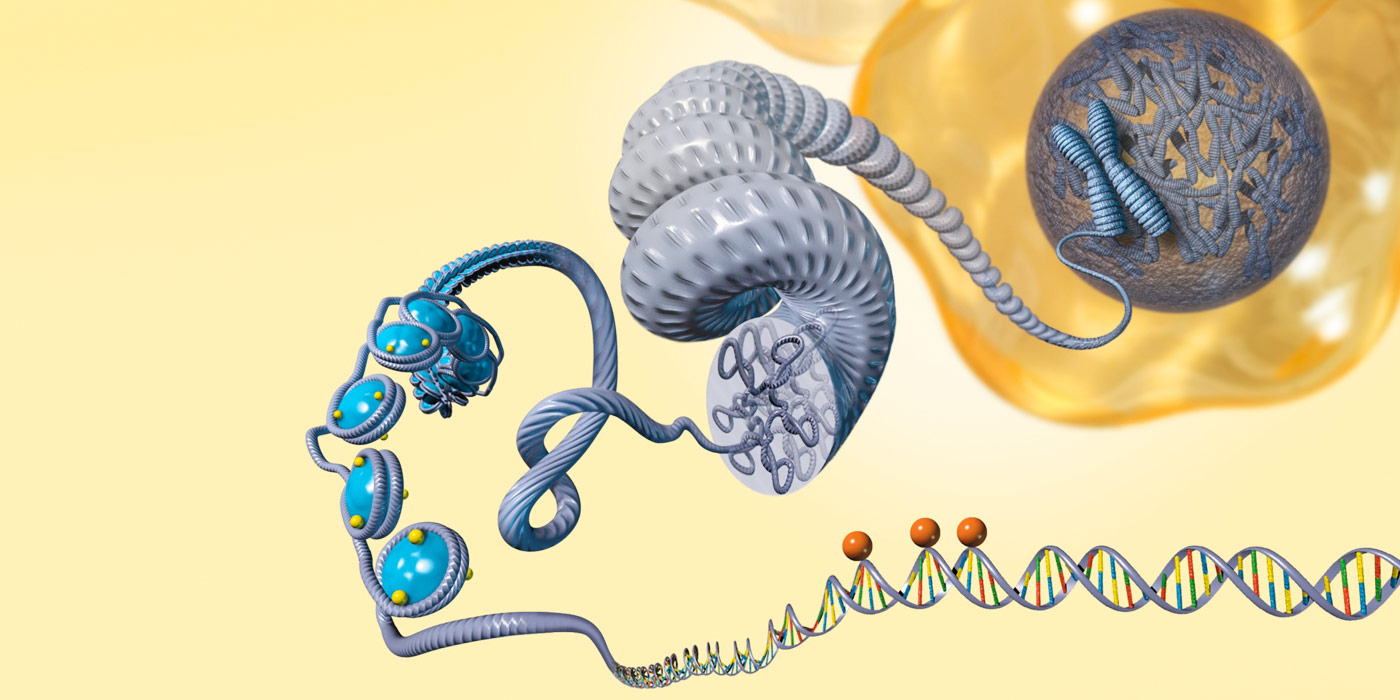
دکتر آرنولد در ابتدا تلاش کرد از طراحی منطقی استفاده کند و برای ساخت آنزیم های جدید، یعنی پروتئین هایی که در واکنش های شیمیایی نقش کاتالیزور را بازی می کنند، منطق و دانش موجود درباره طرز کار پروتئین ها را بکار گیرد، اما آنزیم ها مولکول هایی بزرگ و پیچیده اند که بعضی از آنها از هزاران اسید آمینه تشکیل شده اند و فهم نحوه عملکرد آنها دشوار است. او می گوید که وقتی در انجام اینکار ناکام شد و نتیجه ای نگرفت، به ناچار رو به تکامل آورد؛ «من از اختراعات طبیعت تقلید کردم، از این فرآیند حیرت انگیز تکامل، تا مولکول ها را اصلاح نژاد کنم؛ همانطور که گربه ها و سگ ها را اصلاح نژاد می کنند.»
او برای این پژوهش درباره تکامل هدفمند، ژن آنزیمی را که می خواست بررسی اش کند، وارد باکتری ها کرد که با سرعت زیادی تولید مثل می کنند. سپس با جهش هایی که در این ژن پدید آورد، توانست طرز کار انواع مختلف آنزیم های حاصل را بررسی کند. او آنزیمی را که بهتر از همه عمل می کرد، انتخاب و این فرآیند را از نو تکرار کرد، درست همانطور که تکامل بقای شایسته ترین ها را طی نسل های متوالی انتخاب می کند.
دکتر آرنولد در اولین آزمایش هایش که در دهه 1990 انجام داد، توانست در نسل سوم آنزیمی تولید کند که 200 برابر قوی تر از آنزیمی بود که کار را با آن آغاز کرده بود. نوآوری بعدی که در مطالب منتشر شده از سوی آکادمی سلطنتی سوئد برجسته شده، توسط ویلم استمر (W. P. C. Stemmer) صورت گرفت؛ یک پژوهشگر هلندی که راهی برای تولید سریع تر مجموعه بزرگتری از آنزیم های جورواجور ابداع کرده بود. این تکنیک که بُر زدن DNA نامیده می شود، نسخه های مختلف یک ژن را از هم جدا و تکه ها را به روش تازه ای با هم ترکیب می کند. اینکار به نوعی معادل مولکولی اختلاط ژنتیکی فرزندان دو جانور است. با این حال دکتر استمر در سال 2013 درگذشت و این جایزه به او تعلق نگرفت. آنزیم های لکه بری که در شوینده های لباس بکار می روند، با این تکنیک ها ساخته شده اند.
سادگی درخشان
دکتر اسمیت و دکتر وینتر برای انجام کار در گوشه دیگری از رشته زیست شناسی ساختنی (Synthetic Biology) به این افتخار نائل شدند؛ رشته ای که در دهه 1980 و پس از آن شکل گرفت که تکنیکی به نام واکنش زنجیره ای پلی مراز (PCR) مضاعف سازی DNA در حجم انبوه را امکانپذیر ساخت. این دو دانشمند در کارشان قدرت باکتریوفاژها (ویروس هایی که باکتری ها را آلوده می کنند) را برای کاربردهایی مهار کرده اند که سرانجام به تولید داروهای جدیدی انجامیده اند و طیفی از بیماری ها را درمان می کنند.
دکتر اسمیت برای شناسایی ژن های ناشناخته ای تلاش می کرد که نقشه ساخت پیتیدهای شناخته شده بودند (منظور از پیتید رشته های کوتاه پروتئین است). معلوم شد که باکتریوفاژها که از رشته ای DNA درون کپسولی پروتئینی تشکیل می شوند، ابزارهای سودمندی هستند. او انواع ژن هایی را که مناسب به نظر می رسیدند، درون DNA فاژها کار گذاشت. سپس فاژها این پروتئین ها را به پوشش خارجی شان افزودند. پادتن (یا آنتی بادی) شبیه کلیدی است که به یک قفل پروتئینی خاص می خورد. دستگاه ایمنی بدن از پادتن ها برای شناسایی عوامل بیماری زای مهاجم استفاده می کند. هنگامی که فاژی موفق به اتصال به یک پادتن شناخته شده می شود، دانشمندان می توانند میان آن پیتید و ژنی که آن را تولید کرده، ارتباط برقرار کنند.
آکادمی نوبل این رویکرد را که نمایش فاژ نامیده می شود، در سادگی اش درخشان توصیف کرده است. دکتر اسمیت اعتبار این جایزه را به برندگان دیگر، به ویژه دکتر وینتر، منسوب می کند. دکتر اسمیت در یک کنفرانس خبری اعلام کرد: «آنها این جایزه نوبل را برای من بردند و خودشان هم آن را گرفتند.» او گفت که دو برنده دیگر راه هایی برای کاربرد این فناوری یافتند که او برای پیشرفت های بعدی ابداع کرده بود. «من آنقدر باهوش نبودم که پیش بینی کنم این پژوهش به کجا منتهی خواهد شد. دیدگاه من در آن زمان نسبت به اکنون خیلی باریکتر بود.»
فاژها و مسئولیت اخلاقی
دکتر وینتر کار خود را بر مبنای پژوهش های دکتر اسمیت گذاشت و از تکنیک نمایش فاژ برای ساخت پادتن هایی استفاد کرد که می توانستند به عنوان درمانی جدید برای بیماری هایی همچون فلج چندگانه (MS) و سرطان بکار آیند. داروهای سنتی از مولکول های کوچک برای تغییر فرآیندهای درون سلول استفاده می کنند. ساخت پادتن از تخصص شرکت های داروسازی بزرگ خارج بود. دکتر وینتر طی یک کنفرانس خبری تلفنی اعلام کرد: «در ابتدای دهه 1990 کسی اعتقاد نداشت که پادتن ها ممکن است خاصیت درمانی داشته باشند.»
دکتر وینتر، ژن تولید یک پادتن را وارد فاژها کرد و سپس با بررسی انواع پادتن های حاصل، آنهایی را انتخاب کرد که با اهداف مطلوب پیوند موثرتری برقرار می کردند. تکرار تکامل ژن به تولید پادتن های موثرتری انجامید. اولین داروی پادتنی که به این شیوه ساخته شد، آدالیمومب (Adalimumab) با نام تجاری هیومیرا (Humira)، در سال 2002 برای درمان روماتیسم مفصلی، صدفک و بیماری التهاب روده تاییدیه گرفت. از پادتن های دیگر برای کشتن سلول های سرطانی، خنثی کردن سیاه زخم و آهسته تر کردن روند پیشرفت یک بیماری خودایمنی به نام لوپوس استفاده می شود. پادتن های دیگری نیز هستند که تاثیر آنها در درمان بیماری هایی همچون آلزایمر در دست بررسی است.
دکتر وینتر گفت که در ابتدای دوران کار حرفه ای خود، پیش از کار با باکتریوفاژها در جستجوی شناختی علمی و پایه از تکامل بود؛ علم به خاطر خود علم. او توانست یک پادتن موش را چنان دستکاری کند که در بدن انسان تاثیر بگذارد. سپس از آن برای درمان زنی مبتلا به سرطان استفاده کرد. دکتر وینتر می گوید: «ما نمی دانستیم چه اتفاقی خواهد افتاد. در واقع من بسیار نگران بودم که این پادتن بیش از حد وحشی باشد و بیمار را از پا درآورد.» پس از چند روز، تومور سرطان بتدریج کوچکتر شد و وینتر به ملاقات بیمار رفت. می گوید: «رفتم داخل و بانویی دوست داشتنی را دیدم که در آرامش بافتنی می بافت. او از من پرسید که در این باره چه احساسی دارم و من هم رک و پوست کنده گفتم از اینکه نمرده، بسیار خوشحالم.»
رک گویی دکتر وینتر در مقایسه با کلمه های احتیاط آمیزتری که پزشکانش بکار می برند برای آن زن بسیار روحیه بخش بود. او گفت که اگر این درمان آزمایشی عمرش را فقط چند ماه طولانی تر کند نیز خوشحال خواهد شد؛ زیرا شوهرش نیز در حال مرگ است. این تجربه تاثیر ماندگاری بر دکتر وینتر گذاشت. او می گوید: «آنچه این تجربه روی دوش من گذاشت، وظیفه ای اخلاقی بود که در عمل مطمئن شوم آنچه تولید می کنم، می تواند برای منفعت عمومی بکار گرفته شود.»
منابع
مقاله علمی و آموزشی «برندگان نوبل شیمی 2018 چه دستاوردهایی داشتند؟»، نتیجه ی تحقیق و پژوهش، گردآوری، ترجمه و نگارش هیئت تحریریه علمی پورتال یو سی (شما می توانید) می باشد. در این راستا گزارش کاوه فیض الهی در مجله دانشمند، به عنوان منبع اصلی مورد استفاده قرار گرفته است.